2024年4月,生命科学与健康工程学院安海龙教授团队与浙江中医药大学刘伯一研究员以及河北医科大学王川教授团队在国际高水平期刊《Nature Communications》上发表了题为“CXCL5 activates CXCR2 in nociceptive sensory neurons to drive joint pain and inflammation in experimental gouty arthritis”的研究成果。浙江中医药大学博士研究生尹诚语、刘伯宇、河北医科大学董紫珊博士、安海龙教授已毕业博士研究生史赛博士是该文章的共同第一作者,安海龙教授、河北医科大学王川教授、浙江中医药大学刘伯一研究员、方剑乔教授是共同通讯作者。该研究工作表明痛风局部关节内升高的CXCL5通过神经元CXCR2-TRPA1轴引发痛风关节炎疼痛、中性粒细胞流入和炎症,扩大了感觉神经元对免疫调节能力的认知,为急性痛风性关节炎的临床治疗提供了有前景的靶点。
急性痛风性关节炎(Acute gouty arthritis, AGA)作为全球范围内最为常见的炎症性关节炎,通常是由于体内嘌呤代谢途径受损、尿酸排泄减少而导致大量尿酸单钠盐(Monosodium urate, MSU)结晶在关节和周围组织中过量沉积所导致。随着当今社会人口老龄化加剧和饮食结构改变,不良生活方式促使AGA发病率逐年上升且呈向低龄人群蔓延的趋势。AGA起病急骤,常在夜间发作。其临床特征包括趾端关节及周围软组织红肿,皮肤温度升高以及触痛等,被公认为最影响人类的急性痛症之一。目前临床药物疗效较差,且极易导致严重的胃肠损害。MSU在关节中沉积触发固有免疫激活。驻留巨噬细胞吞噬MSU,并释放一系列的细胞因子和趋化因子(例如IL-1β、TNF-α),进而募集中性粒细胞在关节处浸润,是AGA的典型病理学特征。然而,炎症关节中如何产生痛觉信号的机制仍不完全清楚。
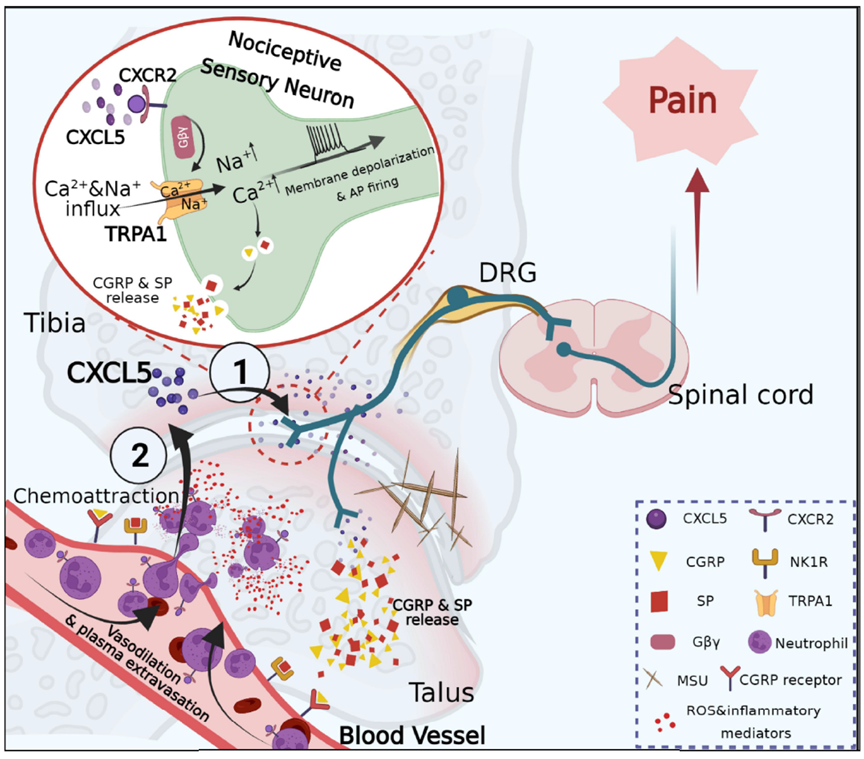
合作团队通过建立AGA小鼠模型和高通量测序技术发现,炎症组织中CXC趋化因子家族成员CXCL5表达显著上调。通过神经元逆行标记技术结合免疫荧光实验发现,其受体CXCR2在支配关节神经元中存在大量表达。细胞钙成像和膜片钳实验发现CXCL5可作用于CXCR2,引发钙内流,造成神经元去极化,导致模型动物出现关节疼痛。分子对接与计算机模拟发现,CXCR2受体活化后其下游Gβ蛋白与痛相关离子通道TRPA1产生耦合,诱导TRPA1通道开放,是神经元活化的关键机制。同时该团队还发现,在痛风条件下,支配炎症关节的外周感觉神经元激活后通过轴突反向分泌大量CGRP和SP神经肽物质,作用于它们的受体,引发血管舒张和血浆外渗,使得CXCL5募集大量中性粒细胞浸润,导致模型小鼠局部组织出现神经源性炎症。浸润的中性粒细胞释放ROS和炎症介质,进一步加剧痛风疼痛和关节炎症。上述结果表明,特异性靶向关节支配感觉神经元中的CXCR2可能是未来痛风性关节炎治疗的一种潜在策略。
原文链接:
https://www.nature.com/articles/s41467-024-47640-7#Sec45

